Gutiérrez M. a
Zambrano G. a
Rodríguez E. a
Resumen: La función principal de los materiales de referencia es ofrecer a los usuarios una base para la obtención de medidas exactas y la comparación de un conjunto de resultados a partir de materiales de referencia a través de rondas de intercomparación, constituyendo una herramienta de calidad para los laboratorios.
El objetivo de este estudio fue comparar el desempeño de los laboratorios participantes en rondas de intercomparación en microbiología de alimentos para la enumeración de Staphylococcus aureus (S.aureus) en matriz leche en polvo, patógeno responsable de brotes alimentarios, con materiales de referencia, los que fueron producidos conforme a los requisitos Guía-ISO 34 y preparados a partir de un liofilizado del microorganismo (S.aureusATCC 25923) y posteriores diluciones con leche en polvo por técnica gravimétrica para lograr una concentración dentro del rango 103 ufc g-1 a 104ufc g-1 (ufc = unidades formadoras de colonias)
Palabras clave: Intercomparación, Material de referencia .
Abstract: The main function of Reference Materials is to offer users a basis for obtaining accurate measurements and the comparison of a set of results from reference materials through rounds of intercomparison, constituting a quality tool for laboratories.
The aim of this study was to compare the performance of laboratories participating in rounds of intercomparison in food microbiology for enumeration of S. aureus in matrix of milk powder, pathogen responsible for foodborne outbreaks, with reference materials which were produced in accordance with the requirements ISO Guide 34 and were prepared from a lyophilized microorganism (S. aureus ATCC 25923) and further dilution with powdered milk by gravimetric technique to achieve a concentration within the range 103 cfu g-1 to 104cfu g-1.
Keywords: Intercomparison, Reference material
1.Introducción
Frente a la necesidad de disponer a nivel nacional de materiales de referencia y materiales de referencia certificados para que los laboratorios de ensayo en el área de microbiología de los alimentos puedan optar a alternativas nacionales y participar en ensayos de aptitud, surgió el desarrollo del área microbiología metrológica que produce materiales de referencia los que han sido utilizados en rondas de intercomparación.
La producción de materiales de referencia en microbiología constituye un proceso de alta complejidad, debido al comportamiento de los microorganismos, una distribución heterogénea, las diferentes integraciones en el medio así como los factores relacionados con características funcionales, diferenciación, metabolismo, fisiología, secreción, entre otros[1].Las características principales de los materiales de referencia corresponden a ser un material suficientemente homogéneo y estable con respecto a propiedades especificadas, establecido como apto para su uso previsto en una medición o en un examen de propiedades cualitativas[2].
2. Materiales y métodos
2.1. Item de ensayo
El material utilizado para las rondas de intercomparación fue producido en una matriz en leche en polvo con una concentración conocida del microorganismo liofilizado (Staphylococcus aureus ATCC 25923) y luego diluido por técnica gravimétrica y posteriormente homogeneizado en una túrbula hasta obtener un producto lo suficientemente homogeneizado.
La verificación de la enumeración de Staphylococcus aureus y la verificación de la concentración alcanzada para las etapas intermedias del proceso y del producto final obtenido, fue realizada conforme a la Norma UNE-EN-ISO 6888-1[3] y la confirmación de las colonias aisladas mediante sistema de identificación automatizado Vitek® 2 Compact y también por prueba de la coagulasa.
Una vez verificado el nivel de concentración establecido, las muestras fueron distribuidas en viales estériles con una masa de 10 g ± 0,1 g.
Los controles a los medios de cultivo fueron realizados de acuerdo a los requisitos de la Norma ISO/TS 11133-1[4] y la evaluación de desempeño de los medios de cultivo por la Norma ISO/TS 11133-2[5].
Los equipos involucrados contaban con la trazabilidad metrológica a las magnitudes de masa y temperatura (balanzas, incubadoras, autoclave, horno de esterilización, medidor de pH, material volumétrico). Para el caso de la calificación del gabinete de bioseguridad, ésta se encontraba dentro del criterio aceptable para la prueba de la verificación del poder germicida de la luz UV con un 99 % y eficiencia de los filtros HEPA con un conteo de 0,01 partículas/m3.
Los controles ambientales fueron desarrollados según el programa de muestreo de superficie con placas de contacto y control de aire del ambiente de trabajo.
Los materiales utilizados que requieren lavado y esterilidad se encontraban dentro del criterio aceptable para el resultado de la verificación por el test de residuos inhibitorios post lavado con ausencia de residuos inhibitorios y el ciclo de esterilización por calor seco y húmedo dentro de lo especificado en tiempo y temperatura (1 hora a 170 °C ± 10 °C y 30 minutos a 121 °C ± 3 °C respectivamente).
2.2. Homogeneidad y estabilidad
Para las pruebas de homogeneidad y estabilidad se realizó el análisis conforme a la Norma UNE-EN- ISO 6888-1[3] para la enumeración de Staphylococcus aureus y la verificación mediante sistema automatizado Vitek® 2 compact y prueba de la coagulasa. Las pruebas de homogeneidad y estabilidad fueron desarrolladas conforme a la ISO –Guide 34[6] e ISO Guide 35[7].La evaluación estadística para la prueba de homogeneidad entre y dentro de los viales, se realizó conforme al estudio de análisis de varianza (ANOVA). Los valores de los recuentos obtenidos en unidades formadoras de colonias por gramo (ufc/g), se transformaron a unidades logarítmicas en base 10 (log10) para obtener una distribución semejante a la distribución normal (distribución log-normal) ya que el comportamiento de los microorganismos obedece a una distribución heterogénea (Poisson).
La evaluación estadística para la prueba de estabilidad se realizó para las variables de temperaturas ≤ -18 °C; 2 °C a 8 °C (refrigerado) y a temperatura ambiente (16 °C a 27 °C). Para las variables se evalúo la varianza y se estudió la variabilidad mediante el índice de Dispersión de Fisher (Χ2).
A temperaturas ≤ -18 °C, se presentó la mejor estabilidad dentro del tiempo de almacenamiento a corto y largo plazo para ambos lotes producidos.
2.3. Criterio de aceptación del lote producido
El lote producido fue aceptado ya que cumplió con los criterios establecidos.Para la prueba de homogeneidad, el lote producido de material de referencia se acepta si se cumple el criterio de la suficiente homogeneidad entre las botellas y dentro de las botellas. Éste es un análisis de varianza que aplica la prueba F donde el F observado debe ser inferior al F crítico para demostrar que no existen diferencias significativas [7].
Los materiales producidos para ensayos de aptitud serán aceptados si demuestran suficiente homogeneidad conforme a la IUPAC para ello se estudió la varianza de las botellas y se estableció el valor crítico. El valor obtenido en la varianza debe ser menor al valor crítico. También se realizó el estudio de suficiente homogeneidad conforme a la Norma ISO 13528[8] donde se calcula la desviación típica entre las botellas y se establece la desviación típica objetivo σ‘p (Horwitz o por desviación histórica obtenida de diferentes experiencias, de la robusta o de ensayo aptitud), donde la desviación típica entre las botellas debe ser menor o igual a 0,3 σ‘p.
Para la prueba de estabilidad, el lote producido de material de referencia es aceptado si se cumple el criterio de la ISO Guide 35[7] donde en base a variable tiempo, curva de regresión tiempo (X) y concentración (Y), determinar el análisis de varianza de la regresión obtenida, evaluar la pendiente obtenida, se establece que no hay inestabilidad observada si:│b1│<t =0,95, para un n=2. El lote del material producido fue aceptado para las tres variables de temperatura.
El índice de Dispersión de Fisher [9](Χ2) se realizó adicionalmente al criterio de IUPAC para el lote 01/02 en las pruebas de homogeneidad y estabilidad, donde se evaluó la homogeneidad de los recuentos en placa.
2.4. Valor Certificado
El valor certificado fue calculado en base a los resultados de las pruebas de homogeneidad de los lotes respectivos por el método de la Norma ISO 6888-1[3].
El valor para la cuantificación de Staphylococcus aureus se realizó utilizando la fórmula estándar conforme al método de ensayo [3, 10].
2.5. Trazabilidad y certificación
La cepa de referencia es trazable a American Type Culture Collection (Staphylococcus aureus ATCC 25923).
La incertidumbre típica combinada uc fue calculada de acuerdo a las directrices para estimación de la incertidumbre del documento GUM [12]y conforme a la Norma ISO/TS19036 [11]. La incertidumbre típica combinada resultó de la combinación de los factores componentes de las incertidumbres asociadas a valores obtenidos en las mediciones de las determinaciones cuantitativas en la caracterización por el método de ensayo por la Norma UNE-EN-ISO 6888-1 [3] y por las pruebas de homogeneidad y estabilidad.
La incertidumbre expandida del valor certificado fue calculada con un factor decobertura para un 95 % de intervalo de confianza como:
La Tabla N°1 presenta el valor certificado e incertidumbre correspondiente para los lotes producidos.

3. Ronda ensayo de aptitud
Cada uno de los laboratorios participantes recibió una muestra debidamente etiquetada y sellada para la Enumeración de Staphylococcus aureus. En el año 2013 se envió el lote 01/02 y los años 2014 y 2015 se envió el lote 01/03.
Asimismo, se les facilitó una guía de reconstitución del ítem de ensayo y les fueron enviadas las instrucciones para manipular el material y realizar el análisis de rutina correspondiente. Del mismo modo, se indicó que debían cumplir con la práctica de estándares de seguridad durante el desarrollo del ensayo.
La verificación de la estabilidad de los materiales se realizó en paralelo a las rondas respectivas por lote.
3.1. Análisis estadístico de la ronda
Para la evaluación estadística se determinó un valor asignado por consenso derivado del análisis de robustez en base a los resultados reportados [13].
Los resultados de los participantes se evaluaron calculando un Z- score obtenido con la media robusta y la desviación típica de la ronda.

4. Resultado y discusión
La producción de estos lotes fue ejecutada conforme a la ISO-Guide 34 General requirements for the competence of reference material producers [6]. Se evaluó la factibilidad de producir material de referencia en una matriz de interés con un analito de impacto en la vigilancia sanitaria de alimentos. Se consideraron las ventajas y dificultades conforme al protocolo de elaboración. Una vez que se obtuvo la definición del proyecto, se comenzó con la planificación de las actividades paso a paso.
El proceso contempló dos etapas principales, la primera correspondiente a la preparación del liofilizado que contiene una concentración conocida del analito. La segunda etapa corresponde a la preparación de la matriz con el analito y la concentración final deseada.
En la primera etapa se verificó la trazabilidad metrológica de los equipos involucrados, se realizó la verificación de los controles ambientales, controles calidad del agua. Se prepararon los materiales estériles y se solicitaron los medios de cultivo requeridos.
A la cepa de Staphylococcus aureus (ATCC 25923) se verificó su pureza, viabilidad y se liofilizó en un medio con crioprotector. Este liofilizado fue mantenido a una temperatura ≤ -18 °C y se verificó su pureza, viabilidad y concentración para ser utilizado en la producción.
Los medios de cultivo y diluyentes fueron elaborados y sometidos a evaluación de desempeño conforme a las Normas ISO 11133-1 y 11133-2 [4,5].
En la segunda etapa se realizaron las diluciones masa/masa para obtener el nivel del rango de concentración deseada. Se verificó el nivel del rango deseado y la el material fue masado y fraccionado en 10 g ± 0,1 g en viales estériles.
En la tercera etapa se realizaron las pruebas de homogeneidad y estabilidad respectivas. Se estimó la incertidumbre de la medición (caracterización método de ensayo) en base a la prueba de test homogeneidad.
Para el test de homogeneidad se seleccionaron en forma aleatoria 10 muestras para ambos lotes en forma aleatoria y se sembraron en duplicado por dos analistas.
Para el test de estabilidad se seleccionaron en forma aleatoria 9 muestras, para el lote 01/03 fueron tres por cada variable de temperatura (≤ -18 °C, 2 °C a 8 °C y 16 °C a 27 °C). Para el lote 01/02 se seleccionaron en forma aleatoria 8 muestras para las variables de temperaturas a ≤ -18 °C y 2 °C a 8 °C respectivamente y 6 muestras para la variable temperatura en el rango 16 °C a 27 °C.
Para ambas pruebas el método de ensayo fue la Norma UNE-EN-ISO 6888-1[3].
El desempeño de los laboratorios se evaluó estadísticamente conforme al método más habitual de ensayos de aptitud microbiológicos mediante el valor consensuado entre los laboratorios participantes. Este valor se determina a partir de la media robusta o la mediana de los resultados de todos los participantes. Los métodos robustos minimizan la influencia de los valores discrepantes.
Por otro lado, el valor certificado del material de referencia utilizado en estas rondas de ensayo de aptitud se ha comparado con los valores asignados de consenso y éstos han resultado ser comparables. Además se ha demostrado con el lote 01/03 consistencia con la estabilidad del material a largo plazo.
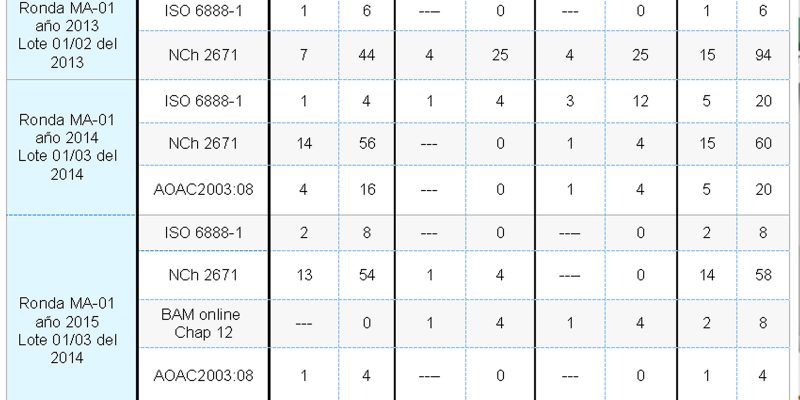
Conforme a lo anterior, los resultados correspondientes para la ronda realizada el año 2013 con el lote 01/02 presentaron de los 16 resultados reportados 8 satisfactorios y 4 cuestionables. La ronda correspondiente al año 2014 con el lote 01/03, de los 25 resultados reportados 19 fueron satisfactorios y 1 cuestionable. Finalmente, la ronda realizada el año 2015 nuevamente con el lote 01/03, de los 24 resultados reportados resultaron 20 resultados satisfactorios y 3 cuestionables. (Tabla N°4).
El porcentaje de resultados satisfactorios para las rondas en el rango de concentración establecido fluctuó entre un 50 % y el 83 %, el rango para los resultados tanto cuestionables como insatisfactorios, se encontraron dentro del 4 % y el 25 %.(Tabla N°4).
Los métodos analíticos reportados por los participantes corresponden a la Norma ISO 6888-1, 1999, NCh 2671: 2002, BAM online Chap 12, AOAC 975:55, AOAC 2003:08. La tabla N°5 resume los resultados obtenidos.



5. Conclusiones
Un material de referencia debe ser lo suficientemente homogéneo y estable. Ambas características son de importancia relevante porque se debe demostrar que es apto para el propósito. En este contexto los resultados obtenidos para la prueba de homogeneidad fueron satisfactorios, demostrándose que no existen diferencias significativas entre y dentro de los viales muestreados aleatoriamente para el test en ambos lotes de producción.
Los resultados obtenidos de los lotes producidos para la prueba de estabilidad a corto plazo fueron satisfactorios, demostrándose que no hay inestabilidad observada en las condiciones de almacenamiento a la temperatura de ≤ -18 °C para ambos lotes. Para las temperaturas de almacenamiento entre 2 °C a 8 °C y 16 °C a 27 °C se observaron diferencias e inestabilidad. El almacenamiento en condiciones de temperatura a ≤ -18 °C asegura que no hay cambios significativos durante el período del estudio al comparar con el tiempo inicial o cero. La estabilidad a largo plazo para cada lote fue comparable con los resultados obtenidos durante el desarrollo de las rondas en las fechas respectivas.
En la tabla N° 3 se presentan los valores asignados al material de referencia producido y los valores de consenso de las rondas respectivas. Se observa que las tres rondas de ensayos de intercomparación han mostrado una buena concordancia entre el valor asignado por consenso y el valor certificado del material de referencia.
La ronda correspondiente del año 2015 presentó el valor más bajo de consenso y hubo mayor porcentaje de cuestionables e insatisfactorios que la ronda del mismo lote realizada en el año anterior.
Referente al valor de consenso, teóricamente no es la mejor opción, sin embargo es ampliamente utilizado y suele ser el único valor posible. Por otra parte es importante considerar que el valor de consenso no necesariamente debe ser idéntico al valor de referencia, en este estudio los valores muestran consistencia con el valor certificado.
Es importante destacar que ninguna de las tres rondas presentó resultados anómalos o extremos que se alejan de la población de datos (outliers), lo que indica que la precisión de los valores aportados por el conjunto de laboratorios y los valores individuales no se aparta del valor más probable asignado por los laboratorios.
Finalmente en la Tabla N°5 se muestran los métodos de analíticos, siendo el método de ensayo más utilizado con un 68 % la Norma NCh 2671 y se observa que al aumentar el número de participantes junto con el incremento de metodologías también se robustece el porcentaje de resultados satisfactorios. Por otra parte el método ISO 6888-1 con el cual se caracterizó el material de referencia correspondió sólo al 12 % (8 de 65 resultados).
Agradecimientos
Los autores agradecen la colaboración del Departamento de Asuntos Científicos del Instituto de Salud Pública de Chile por el trabajo realizado a través de Pablo Díaz M., BQ. Ph.D (c), así como también al soporte logístico de Luis Vilugrón, Ingeniero Civil Biomédico de la Sección de Metrología.
Bibliografía
[1] Wolfgang J. Philipp, Pierre van Iwaarden, Heinz Schimmel, Nele Meeus, Nadine Kollmorgen. Development of reference materials for microbiological analysis. Springer-Verlag 2007 12:134–138.
[2] International vocabulary of metrology (VIM) – Basic and general concepts and associated terms.
[3] UNE-EN-ISO 6888-1 (1999/Amd 2003): Microbiología de los alimentos para consumo humano y animal. Método horizontal para el recuento de estafilococos coagulasa-positivos (Staphylococcus aureus y otras especies). Parte 1: Técnica que utiliza el medio agar de Baird-Parker.
[4] ISO/TS 11133-1 Microbiology of food and animal feeding stuffs–Guidelines on preparation and production of culture media–Part 1: General guidelines on quality assurance for the preparation of culture media in the laboratory.
[5] ISO/TS 11133-2 Microbiology of food and animal feeding stuffs—Guidelines on preparation and production of culture media—Part 2: Practical guidelines on performance testing of culture media.
[6] ISO-GUIDE 34 General requirements for the competence of reference material producers.
[7] ISO-Guide 35 Reference materials — General and statistical principles for certification.
[8] ISO 13528 Statistical methods for use in proficiency testing by interlaboratory comparisons.
[9] Rodríguez A. Luis, Métodos estadísticos en microbiología y ensayos biológicos. 2010 ISBN: 978-956-7770-07-6
[10] ISO 7218 Microbiology of food and animal feeding stuffs—General requirements and guidance for microbiological examinations.
[11] ISO/TS 19036 Microbiology of food and animal feeding stuffs–Guidelines for the estimation of measurement uncertainty for quantitative determinations.
[12] Guide to the expression of uncertainty in measurement (GUM).
[13] ISO/IEC 17043 Evaluación de la conformidad — Requisitos generales para los ensayos de aptitud.
[14] UNE-EN ISO 4833 Microbiología de la cadena alimentaria. Método horizontal para el recuento de microorganismos: técnica de recuento de colonias a 30°C.







Comentarios